Encontramos, na natureza, um grande número de substâncias químicas. O seu estudo constitui o objeto da química, que aprecia a sua composição, as transformações que sofrem, etc. Para isso, entretanto, é preciso distingui-las segundo as suas propriedades, reuni-las em grupos que possuam características semelhantes, etc.
Tipos de substâncias químicas
A primeira noção a reter é a de que há substâncias químicas puras e substâncias químicas misturadas (impuras). Já sabemos o que são moléculas e átomos. Fácil será compreender, pois, que as substâncias puras são aquelas cujas moléculas são todas iguais entre si. É o que rigorosamente se considera uma espécie química.
Não importa que ditas moléculas se componham de átomos iguais ou de átomos diferentes. Em qualquer dos casos estamos diante de uma substância pura ou espécie químicas. Vejamos dois exemplos clássicos: o hidrogênio e o cloreto de sódio.
Estrutura
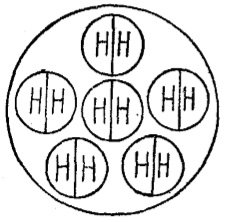
A figura acima nos apresenta, esquematicamente, urna certa porção de hidrogênio, formada por seis moléculas, cada uma delas formada, por sua vez, de dois átomos de hidrogênio. Trata-se, pois, de uma substância pura. Observe-se, agora, a figura abaixo.
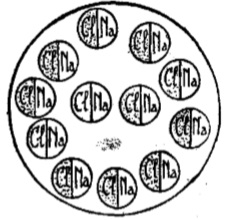
É um esquema representando um fragmento de cloreto de sódio (sal de cozinha). Que vemos? Doze moléculas, cada uma delas – formada por um átomo de cloro (Cl) e um átomo de sódio (Na).
Como se trata de uma substancia constituída de moléculas rigorosamente iguais entre si (cada uma delas formada de um átomo de cloro e outro de sódio), não temos dúvidas em considerá-la, igualmente, urna substância pura.
Substâncias químicas puras
As substâncias químicas puras apresentam, sempre, as mesmas propriedades e constituem o objeto principal da química. Não são comumente encontradas na natureza, onde, de ordinário, se apresentam misturadas, em maior ou menor proporção, a outras substâncias.
Exemplos de substâncias químicas puras
O ouro, por exemplo, espécie química, por vezes é encontrado no Interior de rochas de onde tem de ser extraído por diversos processos. Outros metais precisam de ser retirados dos minérios que os contêm. O ferro apresenta comumente impurezas.

O carvão e o cloreto de sódio quase sempre vêm de mistura a outras substâncias. Só muito raramente se poderá encontrar no leito de um rio, uma pepita de ouro, sem qualquer mistura ou um diamante igualmente puro.
Propriedades da substância química pura
As substâncias químicas puras, estando misturadas a outras, têm as suas propriedades físicas (aspecto, solubilidade, densidade, temperatura de fusão, etc.) alteradas. A água ordinária, por exemplo, aquela que bebemos, não é uma substância pura.
Deixemo-la evaporar num pequeno recipiente, corno seja um pires. Ela deixará, sempre, um resíduo sólido, constante de substâncias que nela se achavam dissolvidas, Só destilando a água é que poderíamos obter o mesmo produto quimicamente puro.
Substâncias químicas misturadas
Ao lado das substâncias químicas puras, existem as substâncias químicas misturadas, isto é, aquelas que ao contrário das primeiras, possuem moléculas diferentes, como o granito, que se compõe de moléculas de quartzo, feldspato e de mica.

Substâncias simples e compostas
As substâncias químicas puras podem ser simples e compostas. Voltemos aos exemplos dados no princípio deste artigo. O hidrogênio é uma substância química simples, porque as suas moléculas são formadas de átomos iguais.
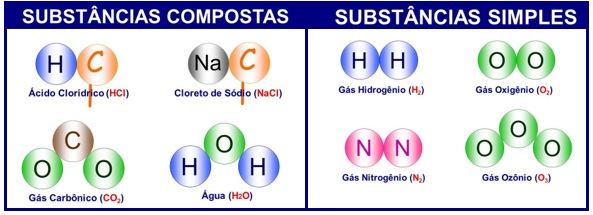
Já o cloreto de sódio é considerado uma substância química composta, porque as suas moléculas são formadas de átomos diferentes. Em tais condições, o hidrogênio não se pode desdobrar. Dele só poderemos tirar hidrogênio e nada mais, como do ouro só tiraremos ouro, e da prata somente prata e assim por diante.
O cloreto de sódio, porém, cujas moléculas vimos serem formadas de átomos de elementos diferentes, poderá ser desdobrado em cloro e sódio, do mesmo modo que a água, em oxigênio e hidrogênio, etc.
Composição
Já vimos que os elementos são (sem entrar em pormenores) os componentes das substâncias químicas. Assim, o ferro (que constitui a substância simples “ferro”), o cloro e o sódio (que formam a substância composta “cloreto de sódio”) são, todos, considerados elementos.
Como se vê, os elementos que, de certo ponto dó vista, são encarados como sinônimos de substâncias químicas simples, devem ser considerados, mais rigorosamente, unidades de composição dás substâncias químicas em geral.
Conhecem-se, hoje, cerca de 100 elementos. Para representá-los, utilizam-se símbolo., que não são mais do que abreviaturas dos nomes pelos quais são conhecidos.
Simbologia dos elementos das substâncias químicas
Alguns dos nomes lembram determinada propriedade do elemento. Ex.: cloro significa verde. Outros se gerem a pátria do seu descobridor. Ex.: polônio (Mme. Curie, que o descobriu, nasceu na Polônia).
Ainda outros se relacionam com planetas. Ex. telúrlo, que significa Terra. Quanto aos símbolos, muitos elementos são representados apenas por sua letra inicial, maiúscula. Por exemplo:
- hidrogênio – H;
- oxigenio – O;
- iodo – I;
- carbono – C.
Outras simbologias
Em virtude de existirem vários elementos cujos nomes começam por C, adicionou-se a esta letra mais outra, tirada do próprio nome. Ex.:
- cloro – Cl;
- cálcio – Ca;
- cobalto – Co.
Alguns símbolos provém do nome do elemento em latim, que em nada se parece com o seu correspondente em português. Ex.:
- S (da palavra latina sulfur) designa o enxôfre;
- Pb (da palavra latina plumbum designa o chumbo;
- K (da palavra latina Kalilum) designa o potássio.
Composição das substâncias químicas compostas
Sendo assim tão numerosos os elementos, compreende-se que as substâncias químicas compostas, isto é, formadas por eles, são em número elevadíssimo, contando-se por centenas de milhares. Mesmo porque, na composição das substâncias, eles entram em número e proporções variáveis.
Se os elementos se exprimem pelos seus respectivos símbolos, as substâncias químicas se exprimem por fórmulas, de que constam os símbolos dos elementos integrantes da molécula e o número de átomos de cada um, representado por um sub-índice. (Quando, de um elemento, há, apenas, um átomo, é dispensável o sub-índice).
Assim, a fórmula da água é H20, porque a sua molécula se compõe de dois átomos de hidrogênio e um de oxigenio. A do cloreto de sódio é NaCl. A do ácido sulfúrico H2SO4.
Substâncias puras e misturadas – Resumo
Continue aprendendo sobre CIÊNCIAS RESUMOS
Gostou desse artigo sobre as substâncias químicas puras e misturadas / simples e compostas? Compartilhe!