A seguir apresentaremos tudo sobre as soluções químicas: suas propriedades, definição, exemplos e dissolução em um resumo completo.
Solução química – Definição
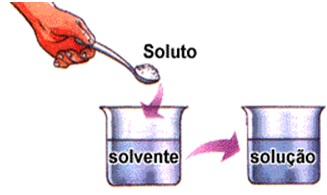
Solução química é, por definição, o nome que damos a misturas homogêneas, nas quais os nossos olhos não percebem a existência de mais de um componente, porque apenas divisam um determinado aspecto.
Exemplos de solução química
A água é considerada o dissolvente universal, porque dissolve quase todas as substâncias, sem alterar a composição delas. Outros exemplos de dissolventes são o éter, o clorofórmio, a benzina, o sulfeto de carbônio e, frequentemente, o álcool, com o qual se fabricam as chamadas tinturas (de iodo, de beladona, de camomila, etc.).
Para facilitar a dissolução química podemos lançar mão de diversos processos. Por exemplo: pulverizar, antes, a substância que se deseja dissolver; ou agitar ambas as substâncias (tanto o solvido como o solvente ou dissolvente); ou, ainda, aquecê-las, depois – de reunidas; porque, realmente, há substâncias que se dissolvem melhor à quente (o alume).
Dissolução de substâncias
Dissolução é um fenômeno mediante o qual urna substância sólida, líquida ou gasosa, desaparece na massa de uma outra, formando, com ela, uma mistura homogênea.
A dissolução química de uma substância numa determinada quantidade de dissolvente tem os seus limites. Chega-se a um ponto em que as partículas da substância que desejamos dissolve; já se não dissolvem. Diz-se, então, que a solução química está saturada, isto é, atingiu o chamado ponto de saturação.
Assim é que, se deitarmos muito açúcar, e cada vez mais, no nosso leite, mexendo sempre, parte dele acabará por depositar-se no fundo do copo, porque o leite ficou saturado de açúcar. Se o levarmos ao fogo, conseguiremos que certa parte do açúcar depositado ainda se dissolva, mas novamente chegaremos a um limite máximo de dissolução química.
Alterações da temperatura do dissolvente
Como se vê, a temperatura faz variar o ponto de saturação da substância. É curioso notar que uma solução química saturada por uma determinada substância pode ainda dissolver outra. O exemplo clássico é a dissolução do sal num soluto já saturado de açúcar.
De um modo geral, a dissolução química de uma substância faz baixar a temperatura do dissolvente. Quando colocamos bastante açúcar no chá quente, notamos que a temperatura do chá baixa um pouco. Se juntamos ao gelo quebrado de uma sorveteria, Igual quantidade de sal, obtemos também um sensível abaixamento de temperatura, que pode atingir até 18° abaixo de zero. Em resumo, tal fenômeno se explica pelo seguinte:
“A mudança de estado de um corpo reclama, sempre, certa quantidade de calor.”
Em ambos os exemplos expostos acima, a dissolução química se realizou graças ao calor cedido pelo dissolvente.
Soluções químicas líquidas de gases
Além das soluções químicas líquidas – aquelas em que, de um modo geral, dissolventes e solvidos são líquidos, há soluções químicas liquidas de gases. O oxigênio de que se aproveitam os animais aquáticos, se acha dissolvido nas águas. O gás carbônico das águas minerais se acha igualmente dissolvido nelas.

Nas soluções químicas gasosas, finalmente, são gasosos tanto o dissolvente como o solvido. O melhor exemplo é o ar atmosférico, no qual o nitrogênio desempenha o papel de dissolvente – por existir em maior quantidade – e os demais gases – oxigênio, gás carbônico e outros – são os solvidos.
Soluções químicas sólidas
Nas soluções químicas sólidas, tanto o dissolvente como o solvido são sólidos. O vidro corado é bom exemplo, sendo o dissolvente o próprio vidro é o solvido -representado pelos óxidos empregados para colori-lo.
Separação de componentes químicos através da destilação
Pela destilação, processo lá estudado, podemos separar dois ou mais liquidas componentes de uma solução química, mas, isso, somente se eles ‘tiverem pontos de ebulição diferentes. De fato, se colocarmos no alambique uma mistura de álcool e água, observaremos (com a ajuda de termômetros) que a 78° (ponto de ebulição do álcool), inicia-se a destilação, proporcionando-nos o álcool destilado.
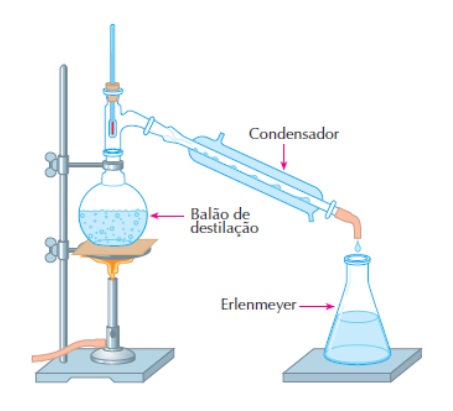
Depois, cessa a destilação, para recomeçar a 100°, quando a água entra em ebulição. Aparando o produto dessa segunda destilação, temos em mãos a água destilada. Eis o que se chama destilação fracionada. Para separar substâncias componentes de misturas heterogêneas (como são, por exemplo, as de sólido com líquidos), lançamos mão da filtração e da decantação da solução química.
Separação de componentes químicos através da filtração
A filtração consiste em fazer passar a solução química através de um filtro. Este pode ser qualquer pano de malhas estreitas, capazes de reter as partículas solidas de diâmetro maior. É assim que coamos café, caldos de frutas, etc., no meio doméstico. Ainda aí usam-se velas de porcelana porosa para filtrara água, libertando-a de impurezas que porventura contenha.
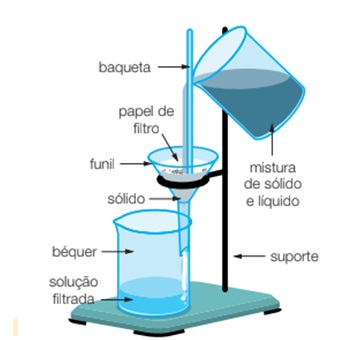
Nos laboratórios, utilizam-se os chamados papéis de filtro, dobrados convenientemente, a maneira de funil. Se a solução química é muito espessa (xaropes, gomas, etc.), empregam-se substâncias como feltro, a flanela, o algodão; se é cáustico (ácidos diversos), prefere-se o “algodão de vidro”, que não é mala do que vidro reduzido a finas agulhas entrelaçadas.
Tratamento de água nas cidades através da filtração
Para filtrar grandes quantidades de água, como as que se destinam ao abastecimento das cidades, faz-se passar a água através de enormes filtros constituídos de camadas superpostas de pedra, carvão e areia, onde ficam as impurezas que o liquido traz consigo. O ar impuro também é passível de ser filtrado para insuflação posterior em teatro, cinemas, escritórios, etc., ou, então, através de máscaras usadas pelos operários em trabalho.
Decantação
A decantação é outro processo destinado a libertar uma solução química líquida qualquer, das partículas sólidas nele existentes.
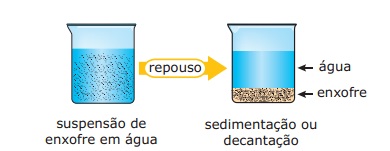
Deixa-se repousar o liquido de modo que as partículas caiam no fundo do recipiente e, depois, sem agitar este recipiente, derrama-se o líquido em outro, cautelosamente, para que o depósito não seja arrastado, durante a operação. A passagem da solução química de um vaso para outro também pode ser feita indiretamente, por meio de sifões.
Soluções químicas – Definição e Resumo
Continue aprendendo sobre CIÊNCIAS RESUMOS
Gostou desse resumo sobre a definição de soluções químicas? Compartilhe!


