A seguir, abordaremos a definição de Lei da conservação da massa, com exemplos de experimento específicos.
A massa, ou quantidade de matéria que compõe os corpos, é invariável, quaisquer que sejam os fenômenos ou reações a que for submetida. O exemplo abaixo esclarecerá o assunto.
Lei da conservação de massa – experimento
Observe a figura abaixo. Nesse experimento, num dos pratos da balança, sob uma campânula de vidro, foi colocada uma vela acesa, juntamente com um pouco de cal, destinada a absorver os gases incomburentes, possibilitando a combustão por bastante tempo.
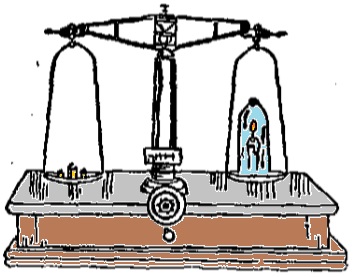
A vela continuará ardendo dando-nos a ilusão de que está sendo destruída. A verdade, porém, é que ela apenas muda de aspecto, porque os gases que se estão formando, as partículas de carbônio, etc., resultantes da combustão, pesam tanto quanto a parte consumida em virtude de reações químicas processadas entre os elementos da vela e o oxigênio do ar.
Resultado do experimento
No experimento utilizado como exemplo, não houve diminuição nem aumento de massa. E a prova está em que, embora a vela tenha ardido completamente, o equilíbrio da balança não foi alterado.
Se a vela tivesse ardido ao ar livre, os gases produzidos pela combustão se teriam difundido pelo espaço e o equilíbrio da balança se teria desfeito. Caracteriza-se então um exemplo de lei da conservação da massa.
Análise do exemplo
O que presenciamos no experimento utilizado como exemplo, vendo arder a vela num recipiente fechado, presenciaremos com qualquer outra substância.
“Nada se cria nas operações da arte nem nas da natureza e pode estabelecer-se em princípio que, em toda operação, há uma quantidade igual de matéria antes e depois da operação; que a quantidade dos princípios é a mesma e que não há senão trocas, modificações”. – LAVOISIER.
O que deduzimos da experiência praticada com a vela é que “a massa de um composto é igual à soma das massas dos seus componentes”, ou, em outras palavras: “A massa é invariável nas reações químicas”, a lei da conservação da massa.
Desdobramento de elementos
Com efeito, suponhamos um experimento. Ao observar a decomposição da água colocada em um voltâmetro, temos a impressão ilusória de que a água “desapareceu”, quando a verdade é que ela se desdobrou nos seus elementos constituintes – oxigênio e hidrogênio.
Se recebermos os gases resultantes da de composição da água e os pesarmos, verificaremos que a massa dos dois é exatamente igual à da água que foi decomposta pelo voltâmetro.
Lei das proporções definidas
Esta lei, formulada por Proust, rege a composição das espécies químicas, ensinando-nos que as substâncias se combinam em proporções invariáveis. Ela pode ser assim enunciada:
“As proporções segundo as quais duas substâncias se combinam para formar uma terceira, são definidas e invariáveis”.
Observe os exemplos de combinação abaixo:
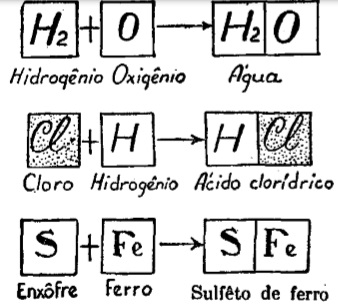
Em qualquer deles, as substâncias empregadas se acham em determinadas proporções. Se assim não acontecesse, a reação se daria de qualquer modo, mas, sobraria, sem reagir, a parte do reagente que se achasse em excesso.
Por exemplo: ao combinar o enxofre e o ferro, para a formação de sulfeto de ferro, empregamos 28 gramas de ferro e 16 de enxofre. Se empregássemos 30 gramas de ferro e 16 de enxofre, os gramas excedentes não se combinariam, isto é, ficariam sobrando.
Lei da conservação da massa – Exemplo e experimento
Continue aprendendo com CIÊNCIAS RESUMOS
Gostou desse exemplo de experimento sobre a lei de conservação da massa? Compartilhe!


