Nesse artigo, você irá aprender tudo sobre as propriedades gerais da matéria química, conhecendo os estado físicos da matéria em um resumo completo.
Definição: o que é matéria?
A menos imperfeita das definições de matéria 4 a seguinte: Matéria é tudo quanto ocupa um lugar no espaço.
Tudo o que nos cerca, portanto, é matéria: a madeira da mesa em que escrevemos, a tinta de que nos servimos, o ar que entra e sai dos pulmões. Note-se que demos três exemplos relativos aos três estados de propriedades gerais da matéria: sólido, líquido e gasoso. Assim que a matéria se apresenta na natureza, formando corpos.
- Corpos são porções Limitadas de matéria.
Mesmo as coisas mais distantes – as nuvens, o Sol, a Lua, etc. – são formados de matéria. Consequentemente, são corpos. Sucede, apenas, que há diversas propriedades gerais da matéria: cada qualidade se chama substância.
- Substância é a propriedade da matéria de que os corpos são constituídos.
Se considerarmos, pois, um cubo de ouro, um cilindro de prata e uma bolinha de feno, veremos que se trata de corpos, porém, formados de substâncias diferentes. Não esqueçamos, porém, que um corpo pode ser formado de várias substâncias. E que uma substância pode ser formada, por sua vez, de um ou de vários elementos.
- Elementos, são os componentes das substancias.
Constituição das propriedades gerais da matéria
A matéria é constituída dó partículas numerosas, e tão pequenas que se tomam invisíveis aos nossos olhos desarmados: são as moléculas. Por muito tempo se supôs, que as moléculas fossem as menores porções de matéria a que pudesse ser reduzido um corpo. Logo, porém, se chegou à conclusão de que cada molécula se compõe, por sua vez, de partículas ainda menores, chamadas átomos.
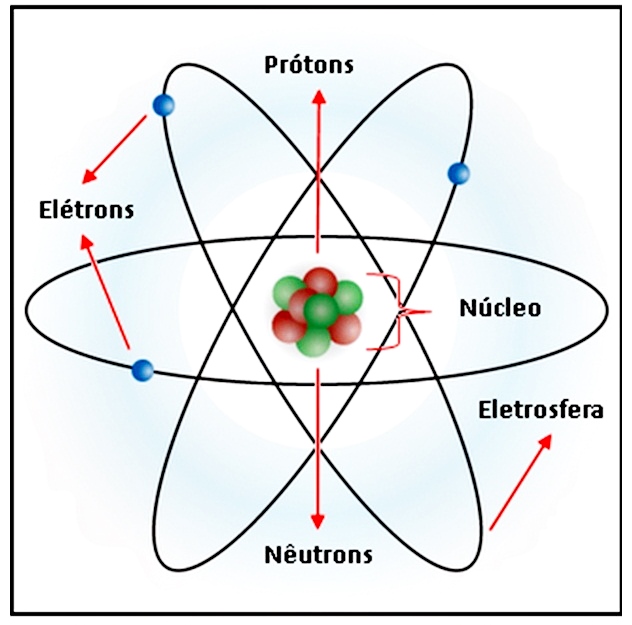
Esta palavra, originária do grego, significa “indivisível”. O progresso da ciência veio provar que o átomo não é indivisível. Ele pode ser fragmentado em partículas ainda menores, denominadas prótons, nêutrons e elétrons.
Estrutura atômica
Os prótons e os nêutrons formam a parte central do átomo, chamada núcleo. Os elétrons se encontram em redor, constituindo a coroa. Os prótons estão carregados de eletricidade positiva; os elétrons estão carregados de eletricidade negativa; os nêutrons não têm carga elétrica explicando-se, assim, o nome com que os batizaram.
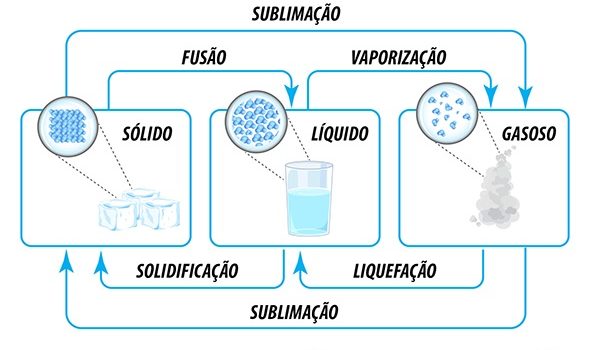
Estados físicos da matéria
Estados físicos das propriedades gerais da matéria podem ser definidas como mudanças de estado físico. Já vimos que os corpos podem achar-se em três estados:
- sólido,
- líquido,
- gasoso.
Estudemos as suas características.
Propriedades gerais da matéria no estado líquido
No estado líquido, os corpos gozam de grande divisíveis. Conservam sempre uma forma determinada e o mesmo volume. Se a forma se modifica, será pela ação de uma força externa, bastante poderosa como a que empregamos, por exemplo, para achatar uma esfera de chumbo.

O corpo, sólido que tem uma utilidade definida toma o nome especial de objeto: uma régua, urna tesoura, um lápis. No estado líquido, os corpos gozam de grande mobilidade. O seu volume é inalterável, porém, a forma varia de acordo com o recipiente onde forem colocados.
Experimento
Lancemos meio litro de água numa bacia, ou num jarro, ou numa chaleira. Ela ocupará todas as reentrâncias desses recipientes, mas conservará intacto o seu volume: meio litro. E a sua superfície livre é sempre plana e horizontal.
No estado gasoso, finalmente, os corpos no têm forma, nem volume próprios, tendendo a ocupar todo o espaço que lhes for proporcionado. Isso se deve à sua expansibilidade.Os corpos em estado líquido e em estado gasoso são genericamente chamados fluidos, em virtude de sua fluidez.
Propriedades gerais da matéria no estado sólido
O comportamento diferente das propriedades gerais da matéria nos três estados sob os quais se apresenta, é devido a duas forças intermoleculares; a de coesão e a de repulsão.

A força de coesão provoca, a atração das moléculas; a força de repulsão, o afastamento delas. Nos sólidos, a primeira é maior do que a segunda, o que faz com que tais corpos se tornem consistentes e só dificilmente se deixem fragmentar.
Propriedades gerais da matéria no estado gasoso
Nos corpos gasosos, as propriedades gerais da matéria se dão ao contrário: as moléculas, graças à força de repulsão, tendem a afastar-se o mais possível, de onde variação constante do seu volume.

Finalmente, nos corpos líquidos, as duas forças se equilibram, permitindo alterações constantes da forma do corpo.
Estados físicos intermediários
Admitem-se outros estados de agregação das substâncias, como o pastoso, intermediário entre o sólido e o liquido. São realmente chamados estados Intermediários. É o caso da banha, da graxa, da manteiga, exemplos que podem ser estendidos aos metais fundidos, ao vidro derretido, etc. Os estados sólido, líquido e gasoso são, entretanto, os mais definidos e comuns.
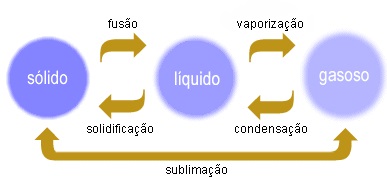
Mudanças nas propriedades gerais da matéria
Os corpos podem passar de um estado a outro, alterando assim as propriedades gerais da matéria. Tais mudanças ocorrem por variações de temperaturas e de pressão. Consideremos as seguintes:
- fusão,
- solidificação,
- evaporação e vaporização,
- liquefação,
- sublimação.
Fusão
Tomemos um cubo de gelo. Coloquemo-lo num pires e esperemos um pouco. Logo que, elevando-se, a temperatura atinge 0° o gelo se derrete, isto é, se fundi. À pressão normal, cada corpo tem o seu ponto de fusão determinado. Podemos conseguir a fusão Isolada de cada um dos componentes de uma determinada mistura, desde que tenham pontos de fusão diferentes.
Aquece-se lentamente a mistura e, à proporção que a temperatura aumenta, se vai observando a fusão sucessiva dos seus componentes. (O aquecimento lento se consegue a “banho-Maria”, isto é, expondo-se a substância ao vapor-d ‘água ou à própria água aquecida).
Propriedades gerais da fusão
A fusão se acha subordinada a duas leis importantes das propriedades gerais da matéria:
- as substâncias se fundem sempre à mesma temperatura (é o ponto de fusão) e sob determinada pressão. Ex.: o gelo se funde a 0°; o chumbo, a 327° ; o ferro, a 1500°, etc.
- durante a fusão, a temperatura da substância permanece sempre a mesma e igual à do ponto de fusão. Em outras palavras: enquanto dura a fusão, todo o calor disponível é empregado em realizá-la, não havendo, portanto; na intimidade da substância, aumento de temperatura.
Em resumo: fusão é a passagem de um corpo, do estado sólido para o estado líquido.
Solidificação
Se levarmos um bocado de água ao congelador de um refrigerador, veremos que, ao baixar a temperatura a 0°, ela se congela, isto é, se solidifica. (Congelação é o nome especial que se dá à solidificação da água).
Ao se solidificarem, as substâncias diminuem; em sua maioria, de volume. A água, do mesmo modo que a prata, e o ferro, são exceções (porque, quando líquidos, têm densidade maior devido a mudanças nas propriedades gerais da matéria).
Ponto de solidificação
O ponto de solidificação de determinada substância é igual ao seu ponto de fusão. Exemplo: a água em estado líquido se solidifica a 0°; a água em estado sólido (gelo) se funde também a 0°. Essa é a primeira lei da solidificação. A segunda se refere à temperatura da substância durante a solidificação, que é sempre, a mesma e igual à do ponto de fusão.
Em resumo: Solidificação é a passagem de um corpo, do estado líquido para o estado sólido.
Evaporação
Certa quantidade de água deixada exposta ao ar, em temperatura normal, acaba por passar, lentamente, ao estado de vapor. É o que se chama evaporação. A evaporação é tanto mais intensa quanto maior for a superfície de contato da substância com o ar. Por isso, um bocado de água, dentro de uma garrafa aberta, se evapora mais lentamente do que se estiver contido, digamos, numa bacia.
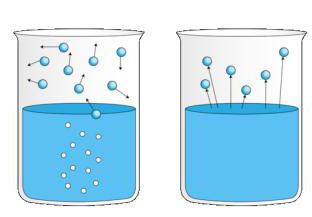
A secura do ar e a sua movimentação concorrem, também, para acentuar o fenômeno. Devemos ainda lembrar que a evaporação é continua: só se suspende quando todo o liquido se houver evaporado, se o corpo for aquecido, a mudança das propriedades gerais da matéria e, consequentemente, de seu estado físico, se dará mais rapidamente, denominando-se vaporização.
Ebulição
Se o aquecimento chegar a provocar formação tumultuosa de bolhas, a vaporização tomará o nome especial de ebulição. Varia, de uma substância para outra, o ponto de ebulição, que é, entretanto, fixo, para cada substância. Á água entra em ebulição a 100°; o éter, a 84°; o álcool, a 78°.
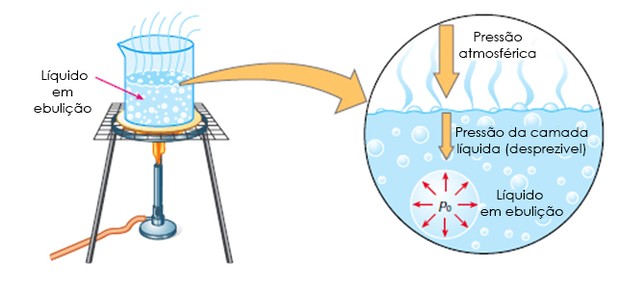
Certos líquidos só emitem vapores quando submetidos a altas temperaturas. Bons exemplos são os óleos, até chamados líquidos fixos. Outros existem que já os emitem em baixa temperatura como se dá com o éter. Esse fenômeno tem o nome especial de volatilização e os líquidos a ele sujeitos se denominam voláteis.
Em resumo: Evaporação é a passagem lenta de um corpo, do estado líquido ao estado de vapor.
Liquefação
Observem-se os vapores que se desprendem de um liquido aquecido: encontrando uma temperatura mais fria, as propriedades gerais da matéria são alteradas, voltando ao estado liquido.
Aquilo que nos parece fumaça saindo do bico de urna chaleira contendo água e posta ao fogo, não é fumaça, mas, vapor-d’ água. Entretanto em contato com uma superfície fria, condensa-se, isto é, liquefaz-se. Os gases e vapores têm, todos, uma temperatura determinada sob a qual se liquefazem.
Em resumo: Liquefação é a passagem de um corpo, do estado gasoso para o estado líquido. É também, chamada condensação. Dá-se por alterações nas propriedades gerais da matéria, por conta da diminuição de temperatura, por aumento de pressão ou por ambas as causas.
Sublimação
Tomemos um pouco de iodo metalóidico. Coloquemo-nos numa cápsula de porcelana, tendo o cuidado de tudo cobrir com um funil, de cartolina. Aqueçamos o iodo brandamente, durante algum tempo. E deixemo-lo, depois, esfriar. Observaremos, então, nas paredes internas do funil, pequenos cristais de iodo. Que aconteceu? O referido corpo aquecido, deu origem a vapores, isto é, passou, diretamente, do estado sólido ao estado gasoso devido a alterações nas propriedades gerais da matéria.
Em resumo: Sublimação é a passagem direta de um corpo, do estado sólido ao estado gasoso.
Os vapores de iodo, entrando em contato tom as paredes frias da cartolina, produziram cristais, passando, diretamente, do estado gasoso ao estado sólido.
Em resumo: Ressublimação é a passagem, direta, do estado gasoso ao estado sólido.
Um dos objetivos da sublimação é purificar certas substâncias. O iodo bissublimado é um produto isento de impurezas.
Características das propriedades gerais da matéria
As propriedades gerais da matéria essenciais pertencem a todos os corpos, quaisquer que eles sejam. São a extensão e a impenetrabilidade.
- Extensão é a propriedade da matéria que têm os corpos de ocupar uma certa porção de espaço.
- Impenetrabilidade é a propriedade em virtude da qual dois ou mais corpos não podem ocupar, no mesmo instante, o mesmo espaço. Com efeito, isto nunca é possível, embora aos nossos olhos algumas vezes pareça ser.
Exemplos
Quando aprofundamos um prego na madeira, pode pensar-se que o prego passa a ocupar o mesmo espaço que a madeira está ocupando. Não é verdade: as fibras da madeira se deslocam, abrindo espaço à entrada do prego. E quantas vezes a madeira racha justamente porque teve de dar passagem ao prego?
A melhor prova de que o prego ocupou um espaço anteriormente ocupado pela madeira é a cavidade que fica no lugar de onde o arrancamos. Fixe-se bem, portanto, essa noção: dois corpos não se podem achar, ao mesmo tempo, no mesmo lugar.
Outras propriedades gerais da matéria química
Outras propriedades gerais da matéria química que possuem os corpos são:
- a DIVISIBILIDADE, que consiste em poderem os corpos sofrer divisões, até certo ponto, por meios mecânicos, físicos e químicos a POROSIDADE, resultante da existência, em sua intimidade, de espaços, visíveis ou não (poros);
- a COMPRESSIBILIDADE, graças à qual a propriedade da matéria pode ser comprimida, diminuindo de volume pelo desaparecimento dos poros (gases e líquidos são, respectivamente, os corpos mais compressíveis e menos compressível);
- a ELASTICIDADE, que permite aos poros voltar ao seu volume normal uma vez cessada a compressão que os alterou (salvo quando a com. pressão é demasiada, provocando uma deformação definitiva do corpo);
- a MOBILIDADE, em virtude da qual os corpos podem ser postos em movimento;
- a INÉRCIA, propriedade da matéria que não permite aos corpos se moverem espontaneamente quando em repouso ou pararem, por si sós, quando em movimento.
Propriedades gerais da matéria – Resumo
Continue aprendendo com CIÊNCIAS RESUMOS
Gostou desse resumo sobre as propriedades gerais da matéria? Compartilhe!